一、在所有元素原子中,3d轨道的能量均高于4s轨道的能量吗?
不对 在20号元素以前包括20号3d轨道大于4s轨道 原子序数大于21的元素3d小于4s轨道能量 希望对你有帮助
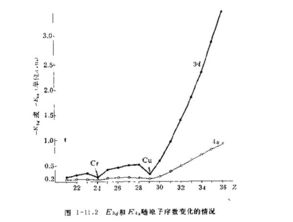
二、在氢原子中,4s和3d哪一种状态能量高
3d高,是能级交错
三、填充电子后,为什么4S能级能量比3d能级能量高
如果没有填充4s电子,先填充3d电子,那3d就是最外层电子,外面没有其它电子罩着,自由度大,受原子核的束缚弱,因此能量高;
如果填充了4s电子后,再填充3d电子,那3d电子就是内层电子,被4s电子罩着,只能在内部规定的空间活动,受原子核的束缚就强了(离原子核较近),所以能量就降低了;
而4s电子则外面没有其它电子层罩着,自由度就高,受原子核束缚弱,因此能量偏高了。
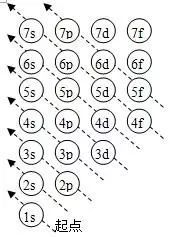
四、为什么钾4s轨道比3d轨道能量低
首先要知道不论哪层电子,它的分布都是遍及整个原子所在的空间(所以,“电子云”的称呼是相当形象的),不同的只是具体分布的情况有差异。
比如4s电子,尽管它最常出现的球壳比3d电子最常出现的球壳要大,但同时4s电子又比3d电子更经常地深入内层(这称为“轨道贯穿”,也可以认为3d电子的轨道更接近于圆轨道,而4s电子的轨道则是扁的椭圆,这样它的远核点更远,而近核点又更近),于是4s电子总的来说受核的吸引更多,受内层其他电子向外的排斥更少,所以其能量较低。
还有一个因素是“原子实的极化”,也是由于4s电子相对来说更常靠近核,它使原子实(核与内层电子构成原子实)极化更严重,于是两者的吸引也更多,这也使能量下降。
五、在电子轨道中,3d的能级为什么还比4s高?还有当四层只有s的时候3d到底算是最外层吗?
首先你要知能级能量的计算公式 能量=n+0.7l(解释一下n和l ) 主量子数n n相同的电子为一个电子层,电子近乎在同样的空间范围内运动,故称主量子数。
当n=1,2,3,4,5,6,7 电子层符号分别为K,L,M,N,O,P,Q。
当主量子数增大,电子出现离核的平均距离也相应增大,电子的能量增加。
例如氢原子中电子的能量完全由主量子数n决定:E=-13.6(eV)/n^2 角量子数l 角量子数l确定原子轨道的形状并在多电子原子中和主量子数一起决定电子的能级。
电子绕核运动,不仅具有一定的能量,而且也有一定的角动量M,它的大小同原子轨道的形状有密切关系。
例如M=0时,即l=0时说明原子中电子运动情况同角度无关,即原子轨道的轨道是球形对称的;
如l=1时,其原子轨道呈哑铃形分布;
如l=2时,则呈花瓣形分布。
3d轨道n=3 l=2 代入计算得能量为4.4 ;
4s轨道n=4 l=0 代入计算得能量为4 小于3d 还有当四层只有s的时候3d到底算是最外层吗? 其实这个只是电子填充的顺序,因为4s能量低,所以电子填充完3p轨道后,优先填充4s轨道,如果4s轨道未填满或恰好填满,那就是最外层。
只要3d轨道有电子,4s轨道就是最外层。
六、4s与3d的能量大小
“离原子核越远,能量越大”用“能级交错”能解释。
“远”只是旧概念,现代理论应是4s轨道的能量低,而不涉及“远与近”。
关于失电子,要看吸收能量多少,而不是本身能量多少。

七、H原子3d与4s能级能量高低 为什么
展开全部因为屏蔽效应使核对外层电子的束缚变小,内层电子对外层电子的排斥力使其远离核~,所以能量升高,望采纳

参考文档
下载:3d为什么比4s层能量大.pdf《股票合并后停牌多久》《机构买进股票可以多久卖出》《买了8万的股票持有多久可打新》《股票回购多久才能涨回》《股票赎回到银行卡多久》下载:3d为什么比4s层能量大.doc更多关于《3d为什么比4s层能量大》的文档...声明:本文来自网络,不代表【股识吧】立场,转载请注明出处:https://www.gupiaozhishiba.com/chapter/70905387.html



